F. Bilangan Kuantum
- Bilangan kuantum utama (n) → nomor kulit
Menunjukkan elektron pada kulit atau tingkat energi utama.
n = 1 disebut kulit K n = 5 disebut kulit O
n = 2 disebut kulit L n = 6 disebut kulit P
n = 3 disebut kulit M n = 7 disebut kulit Q
n = 4 disebut kulit N
- Bilangan Kuantum Azimuth (l) → subkulit
Menunjukkan letak elektron dalam subkulit, bentuk orbital, dan subtingkat energi elektron.
Nilai l = 0 s/d (n-1)
Nilai l maks = (n-1)
l = 0 subkulit s ( 1 orbital )
l = 1 subkulit p ( 3 orbital )
l = 2 subkulit d ( 5 orbital )
l = 3 subkulit f ( 7 orbital )
- Bilangan Kuantum Magnetik (m) → orbital
Menunjukkan orientasi orbital dalam ruangan dan juga menunjukkan banyaknya orbital pada subkulit.
Nilai m = – l s/d + l
- Bilangan kuantum Spin (s) → arah rotasi elektron
Menunjukkan arah putaran elektron dalam orbital. s = +1/2 atau s = -1/2
H. Bentuk Orbital
- Orbital s
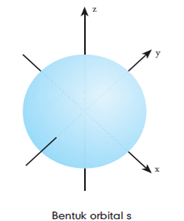
Orbital yang paling sederhana adalah orbital s. Setiap subkulit s terdiri atas 1 buah orbital yang berisi 2 elektron. Orbital s berbentuk bola simetri yang menunjukkan bahwa electron memiliki kerapatan yang sama, jika jarak dari inti atom juga sama. Semakin jauh letak elektron dari inti atom, kerapatannya semakin rendah. Nilai bilangan kuantum utama suatu orbital memengaruhi ukuran orbital. Semakin besar nilai bilangan kuantum utama, ukuran orbitalnya juga semakin besar.
- Orbital p
Bentuk orbital p seperti balon terpilin. Kepadatan elektron tidak tersebar merata, melainkan terkonsentrasi dalam dua daerah yang terbagi sama besar dan terletak pada dua sisi berhadapan dari inti yang terletak di tengah.
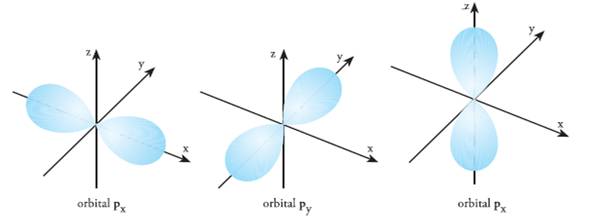
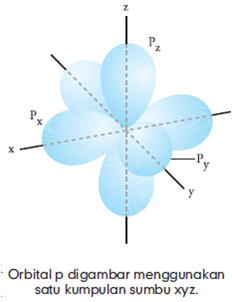
Subkulit p terdiri atas 3 orbital, tiap orbital mempunyai bentuk yang sama. Perbedaan ketiga orbital terletak pada arah, di mana terkonsentrasinya kepadatan elektron. Biasanya orbital p digambarkan menggunakan satu kumpulan sumbu x, y, dan z, sehingga diberi tanda px, py dan pz.
- Orbital d dan f
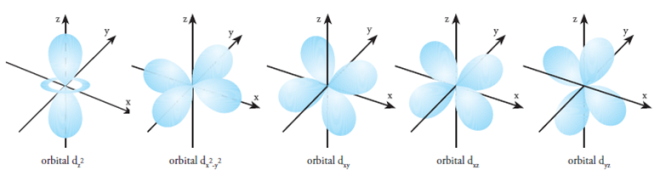
Setiap subkulit d terdiri atas 5 orbital dengan bentuk kelima orbital yang tidak sama. Orientasi orbital d dilambangkan dengan dxy, dxz, dyz, dx2-y2 dan dz2.
Empat orbital mempunyai bentuk yang sama dan setiap orbital mempunyai 4 “lobe” kepadatan elektron. Adapun perbedaannya terletak pada arah berkumpulnya kepadatan elektron. Sementara itu, satu orbital lagi mempunyai bentuk berbeda, tetapi memiliki energi yang sama dengan keempat orbital d lainnya.
Orbital f mempunyai bentuk orbital yang lebih rumit dan lebih kompleks daripada orbital d. Setiap subkulit f mempunyai 7 orbital dengan energi yang setara. Orbital ini hanya digunakan untuk unsur-unsur transisi yang letaknya lebih dalam.
Materi Lengkap : Struktur Atom
Referensi :
- Rini Oktavia : Bentuk Orbital
Materi Terkait:

4 thoughts on “Bilangan Kuantum dan Bentuk Orbital”